当研究室の概要
我々研究室は、心血管病として特に心不全と肺高血症の研究を行っています。研究室の特徴として、臨床医科学者(Physician Scientist)の育成とDiscovery-Based Medicineの実践を目指しており、「心房性ナトリウム利尿ペプチド(ANP)の心不全治療薬へ応用」、「脳性ナトリウム利尿ペプチド(BNP)の心不全診断薬への応用」という世界に先駆けた展開医療(Translational Medicine)の経験に基づき、心血管病の発症進展に深くかかわる心血管ホルモンの発現調節と作用、遺伝子発現調節機構を解明することにより、心血管病の発症・進展のメカニズムをあきらかとし、それらを元に新規治療法を開発することを目指しています。(図1)

現在の具体的な研究内容としては、以下のテーマになります。
研究内容
1)肺高血圧症に関する臨床研究、およびその発症・進展の分子メカニズムの解明と新たな治療法の開発(図2)

肺動脈性肺高血圧症は、以前はまれな疾患と考えられていましたが、最近は膠原病、肺疾患、薬剤性などさまざまな疾患や病態に肺高血圧症が合併し、頻度が多いことが明らかになっています。肺動脈性肺高血圧症は近年の肺血管拡張薬の開発により治療成績が改善していますが、まだ治療困難な症例も多く、病態解明に基づく新規治療法の開発が望まれています。
我々の研究室では、実際の臨床において多数の肺高血圧症例の診療をおこないつつ、基礎研究も行っています。動物実験として、既存のSugen hypoxiaラットなどの肺高血圧モデルに加えて、世界に先駆けて開発した、薬物による肺高血圧モデルマウスを作成し、また培養細胞実験も行い、肺高血圧の発症進展機序の解明と、新たな治療方法の開発を目指しています。
1-1) TRPC6/3シグナルと肺動脈性肺高血圧症
肺高血圧症の発症・進展は、肺動脈平滑筋の異常収縮・増殖による病的肺動脈リモデリングが重要な役割を果たし、肺動脈内皮細胞の機能異常によるエンドセリン-1などの体液性因子の活性化と、それに引き続く、肺動脈血管平滑筋細胞における病的Ca2+シグナルの亢進による病的シグナルの活性化が重要な役割を担っています。
Transient receptor potential(TRP)チャネルは、1989年ショウジョウバエの光受容応答変異株の原因遺伝子としてtrp 遺伝子が発見され、trp をコードするタンパク質(TRP)は,カチオンチャネルを形成し、生理的役割として、温度、機械刺激、化学刺激、浸透圧、酸・塩基,酸化ストレスなど,外界からの様々な刺激により活性化され、細胞内シグナルに変換するセンサーの役割を果たしています。
TRP チャネルスーパーファミリーの1つであるTRPC (TRP classic(canonical))は、サブタイプとして、TRPC1からTRPC7までが報告され、相同性や機能的類似性から,TRPC1/4/5, TRPC2, TRPC3/6/7の3つのサブファミリーに分類されています。TRPC6および3は相同性が高く、6回膜貫通領域を有し、生体内でへテロ4量体を形成することが報告され、アンギオテンシン-Ⅱやエンドセリン-1等の受容体刺激により活性化される事が報告されています。我々研究室ではTRPC6に注目し、病的心血管リモデリングにおけるTRPC6の関与についての研究を行ってまいりました。
共同研究者である信州大学循環器内科学教室の桑原宏一郎教授は、TRPC6が、種々の心肥大モデル動物やヒト拡張型心筋症の心室において発現が亢進し、その下流のcalcineurin-NFAT経路を活性化する事により病的心筋リモデリング進展に関与し、さらにTRPC6の阻害が病的心臓リモデリング抑制に作用する事を報告しました (Kuwahara K, et al. J Clin Invest. 2006)。我々研究室では、ナトリウム利尿ペプチドファミリーであるANP(atrial natriuretic peptide) やBNP (brain natriuretic peptide) が、その共通の受容体であるguanylyl cyclase–A (GC-A) を介して下流のcGMP – PKG 経路を活性化し、PKG がTRPC6を直接リン酸化することにより、TRPC6の活性化を抑制する事を明らかとしました(Kinoshita H, Nakagawa Y, Kuwahara K, et al. Circ Res. 2010)。以上の事は、病的心臓リモデリングの発症・進展にTRPC6が非常に重要な働きをしており、TRPC6阻害による新しい治療法の可能性を示唆するものと考えています。
TRPC6および3は、心臓だけでなく、肺、血管平滑筋、脳、腎臓など全身で発現が見られます。肺動脈性肺高血圧症では、肺動脈平滑筋細胞におけるTRPC6および3の発現が著明に亢進し、特発性肺動脈性肺高血圧症患者において、TRPC6遺伝子発現亢進につながるTRPC6遺伝子プロモーター領域の一塩基多型が、肺高血圧症発症頻度と相関している事が報告されました。TRPC6が肺高血圧症の病態形成に関与している可能性を考え、我々研究室では、肺高血圧動物モデルや培養細胞を用いてTRPC6阻害による肺高血圧症発症・進展抑制効果とそのメカニズムの解明に取り組んでいます。さらに、大阪大学薬学部や京都大学工学部、信州大学との共同研究により新規のTRPCチャネル阻害薬の臨床応用に向けて研究をおこなっております。
1-2) CNP – GC-B 経路と肺動脈性肺高血圧症について
1983年末にANP(atrial natriuretic peptide)が発見されて以降、現在までにナトリウム利尿ペプチドとして3種類の内因性リガンドANP, BNP (brain natriuretic peptide), CNP (C-type natriuretic peptide)が報告されています。CNPは1990年にブタ脳より単離・同定されました。その構造はナトリウム利尿ペプチドに共通する環状部分を有する22個のアミノ酸からなるペプチドである事が報告されています。
ナトリウム利尿ペプチドの受容体として、guanylyl cyclase (GC)-A (NPR-A), GC-B (NPR-B)、clearance受容体 (NPR-C) があり、ANP, BNPはGC-Aに作用し、clearance受容体により分解されるのに対し、CNPはGC-Bに作用し細胞内のcGMPを増加させ、その効果を発揮します。またCNPは clearance受容体にも結合することが報告されています。ANP、BNPは主として心臓で発現し分泌されますが、CNPは骨組織、血管内皮細胞やマクロファージで産生され、血管や骨における局所因子として作用する事が報告されています。
CNP心血管系においては主に血管内皮に存在し、局所においてその受容体であるGC-Bを介してcGMP を増加させ、抗炎症、細胞増殖抑制などの血管保護作用を有することが報告されています。我々の研究室では、血管内皮特異的CNPノックアウトマウス(CNP ecKO)を作成し、CNPが体血圧や血管機能の制御を行っていることを明らかとしました (Nakao, Kuwahara, Nakagawa, Kinoshita et al. Hypertension 2017)。
GC-Bは肺においても高発現しており、肺動脈の制御や肺高血圧症の発症進展に重要な役割を果たしている可能性が考えられています。我々研究室では、肺高血圧症の発症進展をCNPが抑制し、肺動脈性肺高血圧症に対する治療標的となる可能性があると考え、その上流・下流メカニズムの解明、CNPを用いた新規治療法の開発を目指して研究を行っています。
2) 心不全の発症・進展の分子機序の解明とそれを基にした新しい治療法の開発(図3)
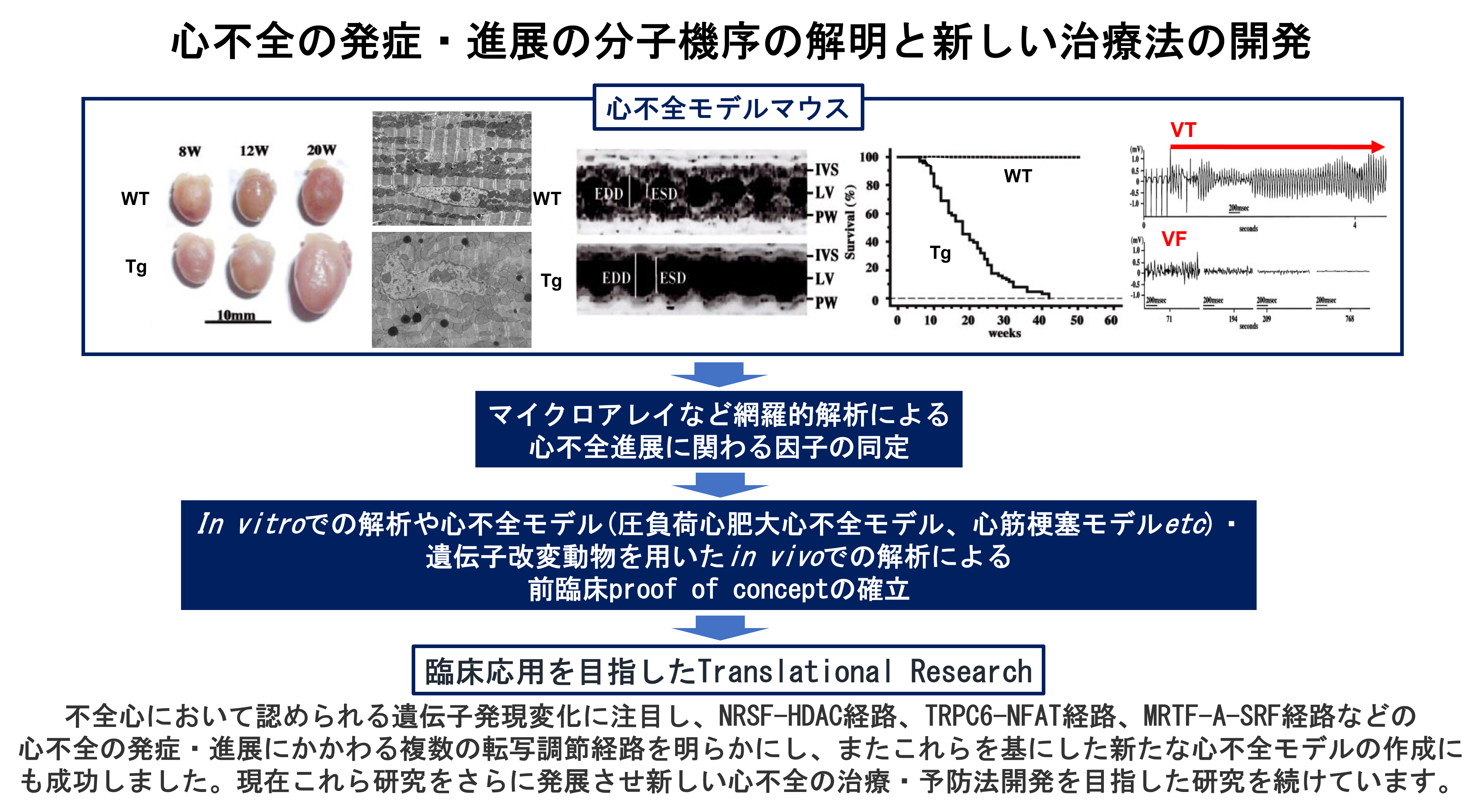
我々研究室では、不全心において認められる遺伝子発現変化に注目し、NRSF-HDAC経路、TRPC6-NFAT経路、MRTF-A-SRF経路などの心不全の発症・進展にかかわる複数の転写調節経路を明らかにました。現在これら研究をさらに発展させ新しい心不全の治療・予防法開発を目指した研究を続けています。
2-1) 心不全・致死性不整脈における NRSF-GαO 経路の役割の解明
我々は、心不全を呈し突然死する NRSF 心筋特異的ノックアウトマウス(NRSF CKO)および優性抑制変異 NRSF 過剰発現マウス(dnNRSF-Tg)を開発し、その遺伝子発現解析により、転写因子NRSFにより制御され、不全心において発現亢進する遺伝子GNAO1と、GNAO1によりコードされるタンパク質GαOに注目し研究を行いました。
GNAO1 のノックアウトマウスとの交配により複数の心不全モデルマウスの心機能低下が改善し、生存率が改善しました。一方でGNAO1心筋特異的過剰発現マウスは通常飼育条件下において、加齢に伴う心機能低下の進行を認めました。これらの分子機序として、GαO の発現亢進が心筋細胞においてL型カルシウムチャネル(LTCC)活性の局在変化を引き起こしT-tubuleでの LTCC 活性の低下と筋細胞膜表面のLTCC活性を亢進させることにより calcium-induced calcium release(CICR)の効率低下と CaMK など病的カルシウムシグナル活性化が起こり、SR機能低下を引き起こすことを明らかにしました (Inazumi H, Kuwahara K, Nakagawa Y, Circ Res. 2022)。以上の結果は、心筋においてNRSF によって発現制御されているGαOが心不全治療の標的となる可能性を示すものと考え、現在新規治療の開発を目指してさらに研究を行っています。
3) 脳性ナトリウム利尿ペプチド(BNP)の前駆体proBNPの臨床的意義及び、proBNPプロセシングメカニズムの解明について(図4)
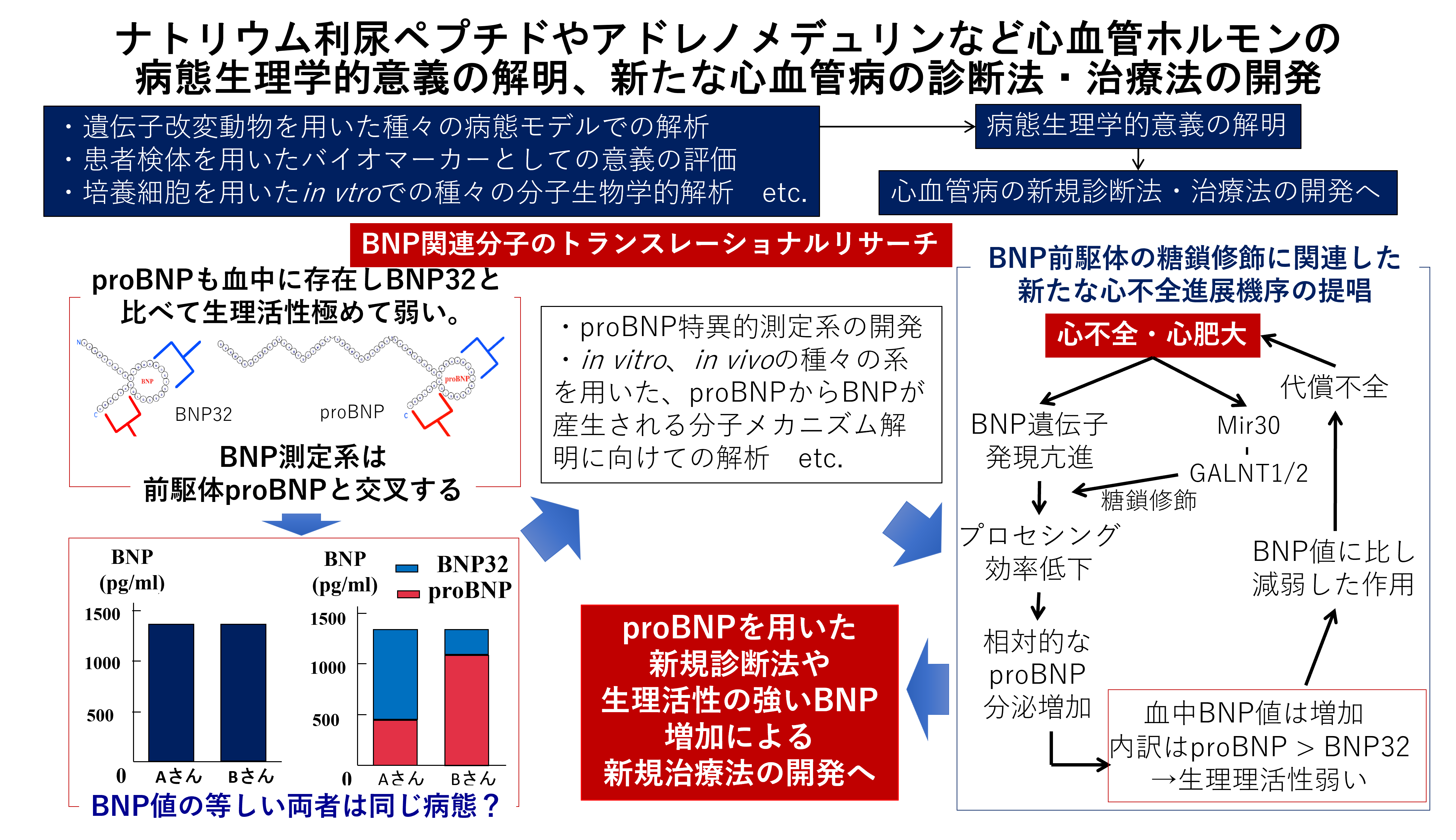
心不全治療薬としてナトリウム利尿ペプチドの分解抑制作用を有する薬剤であるARNIが使用されるようになり、ナトリウム利尿ペプチドについて注目されています。我々研究室では以前からナトリウム利尿ペプチドの研究を精力的に行い、特に近年は、BNPの前駆体proBNP及びその生成機序の解明に基づいた研究を中心に行っています。通常測定されているBNPには、前駆体proBNPが含まれており、心不全患者ではproBNPも血中で増加していることが知られていますが、proBNPの臨床的意義、proBNPからBNPへプロセシングメカニズムの調節機序などは未だ不明でした。公益財団法人田附興風会 医学研究所北野病院 健康管理センター 中川靖章先生、わかくさ竜間リハビリテーション病院院長 錦見俊雄先生を中心に、我々研究室では、不全心でproBNP分泌が亢進し、その分子機序にmiR-30 familyの発現低下によるO型転移酵素GALNT1および2の発現亢進によるproBNPのN末端Thr48/71の糖鎖修飾が関与することなどを既に明らかとしています。現在、各種病態におけるANP, BNPの発現調節とその臨床的意義について引き続き研究を進めています。
また、ナトリウム利尿ペプチド以外にも、アドレノメデュリンなどの心血管ホルモンの病態生理学的意義の解明とそれに基づく新たな心血管病の診断法・治療法の開発を目指して研究を行っています。
メンバー募集
当グループでは、一緒に研究していただけるメンバー(医員、大学院生)を募集しています。連絡は木下秀之までe-mailでお願いします。
e-mail: kinos*kuhp.kyoto-u.ac.jp
(上記*を@に変えてお送り下さい。E-mailの場合のタイトルは「肺循環・心血管内分泌代謝グループ メンバー募集について」と記載して下さい。尚、京都大学医学部附属病院のサーバーシステムの事情により、メール受信がブロックされる場合があります。)