当グループの概要
私たちは分子生物学的な手法を中心として、様々な角度から心血管病の分子メカニズムの解明を目指して研究を進めて参りました。最近はその成果を特許出願できたものも増えており、さらに治療薬開発へ向けた研究を続けています。
研究内容
1.非コードRNAの生体での役割
1990年代初頭までは、分子生物学のセントラルドグマ(Central Dogma)とは、設計図としてのDNAがメッセンジャーRNAに転写され、メッセンジャーRNAがポリペプチドやタンパク質に翻訳されて、遺伝情報を反映して特異的な機能が得られることとされていました。
一方、ヒトゲノム計画によりヒトゲノム30億塩基対の中に存在するタンパク質コード遺伝子約3万個が同定されましたが、通常の遺伝子の占める割合はヒトゲノムの約3%にすぎないことが分かりました。それ以外の非コードDNA領域には、遺伝子の発現、DNA複製の開始、遺伝子増幅や改変を引き起こすホットスポットなどがあることが示されましたが、それ以外にも多くのRNA転写産物があることが分かってきました。これらの非コードRNA(non-coding RNA (ncRNA))は無用のものと長い間考えられていましたが、近年の一連の研究成果から、それらのncRNAが細胞や生体を制御する主要伝達経路において重要な役割を担うことが示唆されてきています(図1)。

中でも、核内の低分子RNAや20塩基程度のmicroRNA(miRNA; miR)には、発生、分化、代謝、発がんにおける機能があることが多くの研究で明らかとなっていますし、それを利用した疾患治療法も開発中です。また、数百から数千塩基対に達する「長鎖ncRNA(long non-coding RNA; lncRNA)」についての研究も最近急速に進展してきています。
①マイクロRNA (microRNA, miR)
タンパク質を作らない、ncRNAの中でmiRNAは、特異的な標的蛋白の翻訳抑制に働いています。miRNAの数は生物の複雑さと共に増加し、ヒトゲノムには約2500個のmiRNAが存在するとみられています。
我々はSREBP-2遺伝子のイントロン16にあるmiR-33a欠損マウスを作成し、血中HDLコレステロールが著増することを見いだしました(Proc Natl Acad Sci U S A. 2010)。このマウスをApoe欠損動脈硬化モデルマウスと交配したところ、著明に動脈硬化の抑制(図2)、脂質の蓄積の低下、および炎症細胞浸潤の抑制が認められました (J Am Heart Assoc. 2012)。

一方、げっ歯類以外の大型の哺乳類においては、SREBP-1遺伝子のイントロンにmiR-33bという同種のマイクロRNAが存在するが、これはマウスにはないため、生体でのmiR-33bの働きが解析できませんでした。我々はmiR-33bノックインマウスを作成し、これがmiR-33欠損マウスと鏡像関係にHDL-Cの低下を示すことを報告しました(Sci Rep. 2014)。さらに、miR-33a過剰発現マウス、臓器特異的miR-33欠損マウスなどの遺伝子改変マウスをすでに作成しており、ヒトサンプルやヒト疾患由来iPS細胞を用いて研究を行ってきました。特に最近では、視床下部のマイクロRNA(miRNA, miR)-33に注目し、これが寒冷刺激の際に交感神経活性化を介して、体温維持に働くことを示しました(Nature Commun. 2021)。miR-33を持たないマウス(miR-33KOマウス)を調べた結果、褐色脂肪細胞の熱産生機能が弱まり、冷たい刺激にさらされた時に体温を維持できなくなっていました。また、このマウスは、エネルギー消費が少なく肥満になりやすいこともわかりました。寒冷刺激により視床下部のmiR-33の量が増加するので、miR-33は交感神経活性の程度を変化させるスイッチとして働いて熱産生を介して、全身の代謝を調節していると考えられました(図3)。

今後も精力的にmiR-33a/bの生理的意義を解明していきます (Life Sci Alliance. 2023, Sci Rep 2022, Nature Communications 2021, FEBS J. 2021 J Am Heart Assoc. 2019, Clin Sci (Lond). 2019, Arterioscler Thromb Vasc Biol. 2018, Mol Cell Biol. 2018, Arterioscler Thromb Vasc Biol. 2017, Circ Res 2017, Circ Res 2015, J Neurosci 2015, Sci Rep 2014, Nature Communications 2013, J Am Heart Assoc. 2012, Proc Natl Acad Sci U S A. 2010, Cardiovascular Res. 2010, J Biol Chem. 2010)。
また、合成核酸によるmiR-33a/bの抑制治療について、2021年に3つの特許出願を行い、国際出願も行っています。さらに臨床応用へむけた研究を継続しています。
②長鎖非コードRNA (long ncRNA, lncRNA)
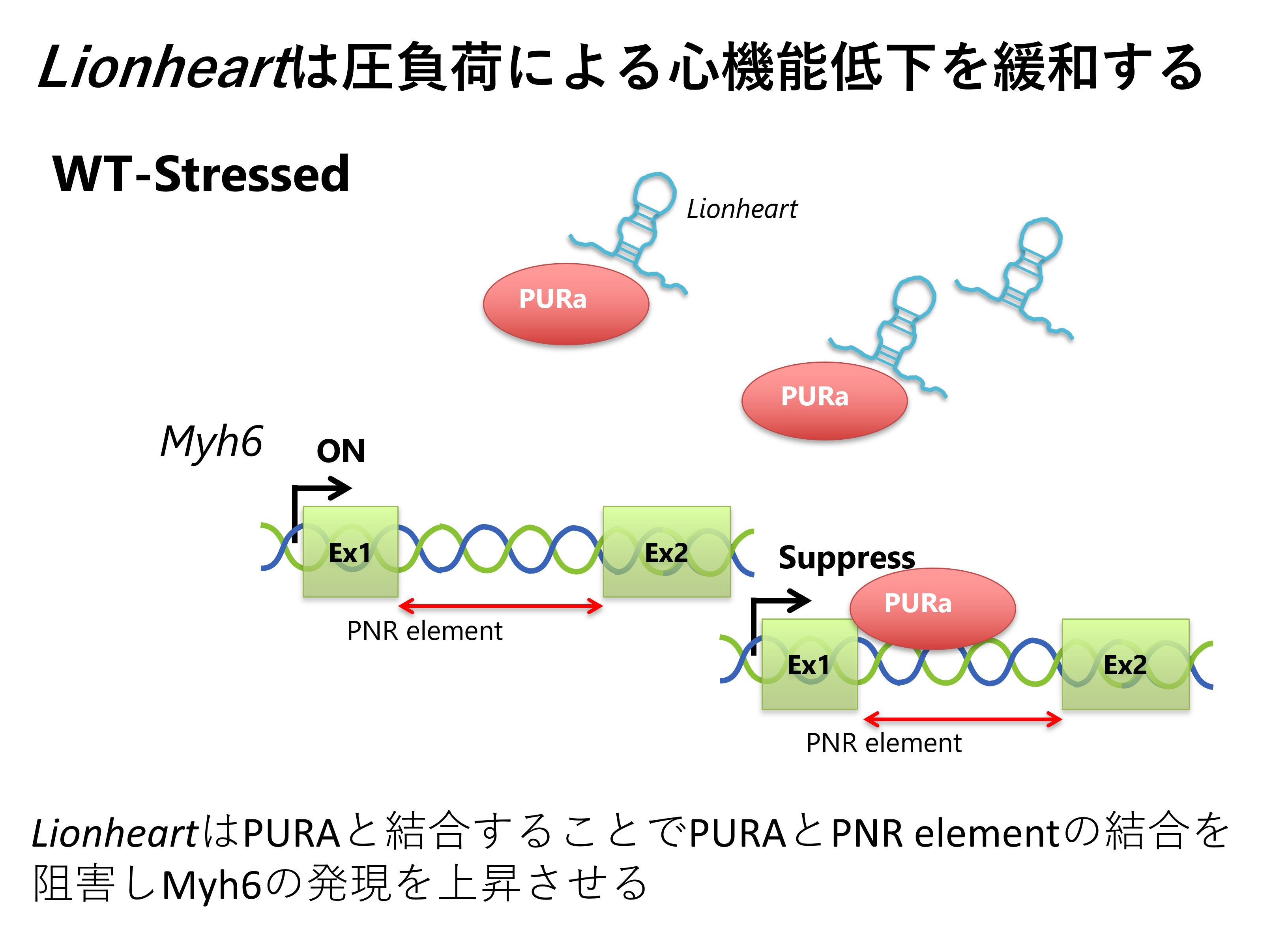
一方、200塩基以上のlncRNAにも重要な働きをするものが存在します。我々は、心肥大や心不全におけるlncRNAの機能を解明するために、心肥大、心不全をきたしたマウス心臓で有意に発現上昇するlncRNAを網羅的に解析し、その機能を検討しました我々はこのlincRNAをLionheartと名付け、論文発表しました(Communications Biology. 2020)(図4)。さらに、その他のlncRNAについても、機能解析実験が進行中です。
③血中・体液中miRNAの診断への応用
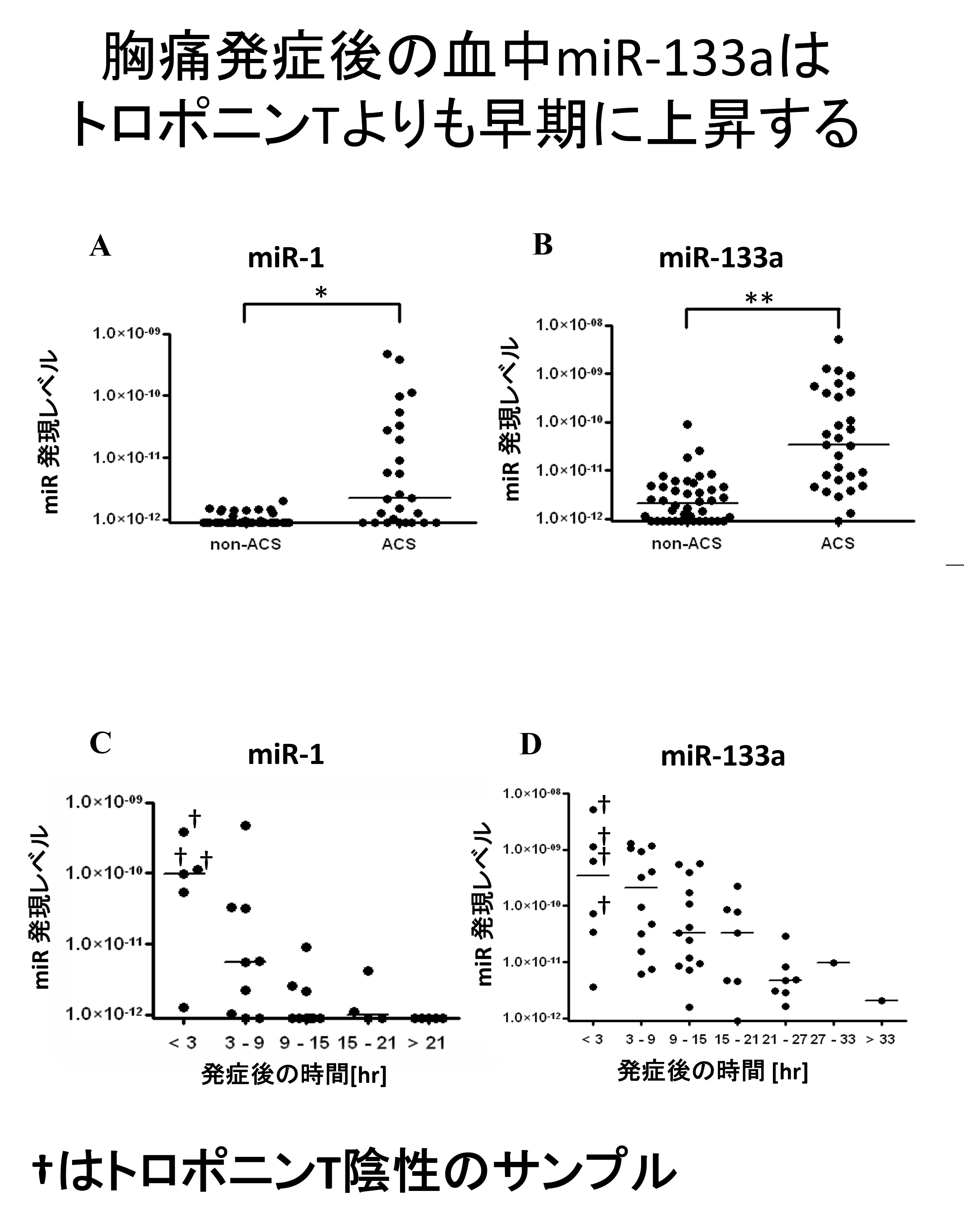
細胞の中だけでなく、血液を含む体液中にもmiRNAが脂質膜に包まれて存在しています。我々は心血管疾患の患者血清中のmiRNAについて検討しました。その結果、急性冠症候群において、胸痛発症後トロポニンTよりも早期に末梢血にmiR-133aが上昇し、これがトロポニンTレベルとよく相関することを見出しました (Circulation: Cardiovascular Genetics. 2011)(図5)。
心筋梗塞におけるmiR-133aの局在を、心筋梗塞後のマウスの心臓においてin situ hybridization法により検討したところ、miR-133aは正常心筋細胞の核周囲に存在し、心筋梗塞巣周辺領域では現象し、梗塞巣においては消失していました。このことより、心筋梗塞においては、心筋細胞中のmiR-133aが血中に流れ出しているものと考えられます。
さらに心血管疾患症例において、血中および体液中のmiRNAが診断マーカーに使えるかどうかについても検討をつづけています(PLoS One. 2015, ESC Heart Failure. 2017)。
2.網羅的スクリーニングによる疾患関連分子の解析
心疾患の発症に関わる新たな分子を見出すことは、分子生物学的研究の醍醐味です。
①シグナルシークエンストラップ法
我々は代謝ストレスに暴露された時に心筋細胞から誘導される分泌蛋白、および膜型蛋白をシグナルシークエンストラップ法によって網羅的にスクリーニングし、Neural cell adhesion molecule (NCAM)というⅠ型膜蛋白を同定しました (J Mol Cell Cardiol. 2010)。さらにヒトの心筋症において、心機能の低下に伴ってNCAMの発現が上昇することも見出しました(Circulation; Heart Failure. 2014)。
②ShRNA/ Whole Genome CRISPR Knockoutライブラリーによるスクリーニング
ShRNAライブラリー(CELLECTA社 DECIPHER)を用いて、細胞増殖、形質転換に関わるHippoシグナルの調節分子を探しました。Hippoシグナル下流のTEAD活性が上昇することを指標に、網羅的なスクリーニングを行ったところ、新規のTEADの抑制因子としてHoxA4を見出し、論文発表しました(EMBO Reports. 2020)(図6)。このHoxA4欠損マウスでは血管平滑筋が増殖型に形質転換し、動脈硬化を生じやすくなることを見出しました。さらにWhole Genome CRISPR Knockout Screeningによる解析を始め、機能的アッセイにより候補遺伝子が得られています。

3.心筋保護による急性心筋梗塞・心不全治療法の開発
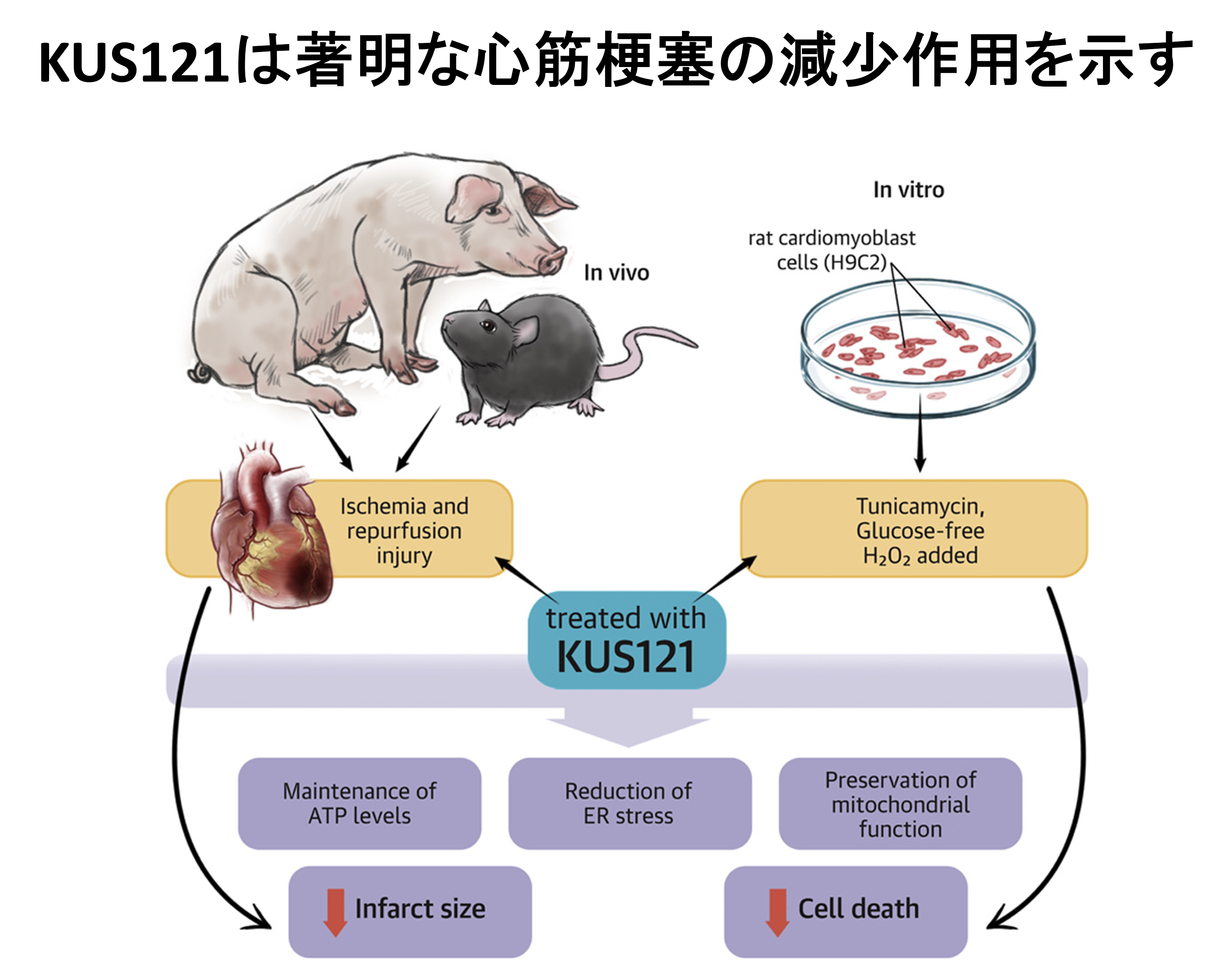
京都大学生命科学研究科の垣塚先生らにより開発されたVCPのATPaseの阻害剤(KUS剤:Kyoto University Substance)は、細胞内のATP減少と小胞体ストレスを軽減し、細胞死を抑制する作用があります。このKUS剤をブタ心筋梗塞モデルに投与すると、著明な心筋梗塞の減少作用が認められました(JACC Basic Transl Sci. 2019)(図7)。心筋梗塞に対する用途特許を申請済みです。さらに心不全についても、KUS121が収縮能と拡張能を同時に改善することを示し、論文報告しました(Biomed Pharmacother. 2024)。また、これについても特許申請を行っています(特願2021-211106; 心機能を改善するための組成物)。現在、心不全治療薬としての臨床応用に向けた研究を行っています。
4.新規シーケンサーによるゲノムの解析
我が国における家族性高脂血症(Familial hypercholesterolemia; FH)患者総数は、25万人以上と推定されます。様々な遺伝性代謝疾患の中でもFHは最も頻度が高く、日常診療においてよく遭遇する疾患といえます。LDLRやPCSK9遺伝子の異常によって、LDL-Cが上昇して動脈硬化性疾患を発症するのですが、冠動脈疾患は、ホモあるいはヘテロのFHで早期に発症することが多く、若いころからの治療開始が望まれます。しかしながら、その診断率は非常に低く、日本では1%以下と考えられています。また、FHの59%の患者さんしか脂質低下療法を受けていないとの報告もあります。
一度に長い塩基の配列を解析できるNanopore sequencerを用いて、FHの遺伝子変異の解析をエクソンのみならず、非コード領域も含めて解析しています(PLoS One. 2024)。
メンバー募集
分子循環器グループでは、熱意を持って一緒に研究してくれるスタッフ(医員、大学院生、学生等)を募集しています。
連絡は尾野 亘までE-mailでお願いします。
e-mail: kohono*kuhp.kyoto-u.ac.jp
(上記*を@に変えてお送り下さい。e-mailの場合、タイトルは、「分子循環器グループ スタッフ募集について」と記載してください。尚、京都大学医学部附属病院のサーバーシステムの事情により、メール受信がブロックされる場合があります。)